
男性型脱毛症(脱毛症)患者におけるNMN(ニコチンアミドモノヌクレオチド)
男性型脱毛症患者におけるFGF5(線維芽細胞成長因子5短縮型)とNMN(ニコチンアミドモノヌクレオチド)を含む成長因子カクテル(セルキュリンTM)の治療効果:分割研究
韓国、高陽市、漢陽大学医科大学ミョンジ病院皮膚科
韓国、高陽市、漢陽大学医科大学ミョンジ病院皮膚科
韓国、高陽市、漢陽大学医科大学ミョンジ病院皮膚科
崇実大学システム生物医学科学部、ソウル、韓国
DOI: 10.15761/GOD.1000229
抽象的な
背景:成長因子とサイトカインを含む成長因子カクテル(GFC)は、脱毛症の新しい治療法として徐々に注目を集めています。いくつかの研究では、マイクロニードルを介したGFCの発毛に対する有効性が報告されていますが、線維芽細胞成長因子5ショート(FGF5s)とニコチンアミドモノヌクレオチド(NMN)を含む処方に関する研究は行われていません。
目的:本研究は、男性型脱毛症(AGA)患者を対象に、GFCにFGF5とNMNを添加したマイクロニードル技術による治療効果を調査することを目的とした。
方法:本研究では、AGA 患者は初回診察から 2 週間間隔で合計 3 か月間、6 回治療を受けました。治療時に頭皮は 2 つのセクションに分けられ、右側は FGF5s と NMN を含む GFC で治療し、左側は生理食塩水で治療し、マイクロニードルで 0.8 mm の深さまで治療しました。合計 20 人の患者 (男性 11 人、女性 9 人) が本研究に含まれました。最終的な治療効果を判断するために、治療前と治療 2 週間後に臨床写真とフォトトリコグラムを実施しました。
結果: GFC を 3 か月間投与した頭皮のフォトトリコグラム画像では、毛髪密度と毛髪直径が増加していることが示されました。対照的に、生理食塩水で投与した頭皮では毛髪密度と毛髪直径に変化はありませんでした。
結論: FGF5s と NMN を併用した GFC とマイクロニードリングは、男性型脱毛症の効果的かつ安全な治療法です。管理された臨床環境でのより徹底した調査による今後の研究が必要です。
キーワード
男性型脱毛症、セルキュリンTM 、線維芽細胞成長因子9ショート、成長因子カクテル、マイクロニードル、ニコチンアミドモノヌクレオチド
導入
男性型脱毛症(AGA)は、男性と女性の両方に共通する脱毛症の頭皮疾患である。最近では、フィナステリドやデュタステリドの経口投与、ミノキシジルの外用が治療として一般的に使用されている [1-3]。さらに、頭皮皮膚自家移植や毛包自家移植などの外科的治療法も実施されている [1-3]。最近では、毛髪の成長と分化に寄与するさまざまなサイトカインに関する研究がいくつか行われており、従来の脱毛症治療とは異なる生化学的治療法が登場している。それに応じて、複数の成長因子とサイトカインを含む成長因子カクテル(GFC)が現在導入されている。GFCの有効性に関する研究に加えて、我々は、毛周期内での成長の開始を促進するFGF9を含むGFC製剤の治療効果を報告した。この治療の核心は、マイクロニードルを介したGFCの経皮吸収であり、毛包からの吸収によって治療効果を発揮する。線維芽細胞成長因子5ショート(FGF5s)は、成長期から退行期への移行を阻害することで成長過程を延長し、ニコチンアミドアデニンジヌクレオチド+(NAD+)の前駆体であるニコチンアミドモノヌクレオチド(NMN)は、細胞のエネルギー代謝に関与し、毛髪の成長を促進します。本研究では、マイクロニードルを使用して、FGF5sとNMNを含むGFCの効果を0.8 mmの深さまで調査しました。
材料と方法
患者
明智病院皮膚科脱毛症クリニックを訪れた患者の中から、男性11名と女性9名を選んだ。開始時に、男性1名と女性3名がプロトコル違反により脱落した。本研究の除外基準には、1年以内に脱毛症の治療を受けている、または脱毛症を引き起こす薬剤を服用している、重度の脂漏性皮膚炎、感染性または重度の炎症性皮膚病変、ケロイド疾患またはコラーゲン、弾性繊維疾患、免疫不全疾患、精神疾患、または免疫不全状態につながる治療を受けているなどが含まれていた。
材料と治療計画
患者全員は皮内吸収用のマイクロニードルを使用した治療を受け、毛髪疾患に対する薬剤の服用や局所治療は行いませんでした。頭皮を2つのセクションに分け、右側はFGF5sとNMNを含むGFCで治療し、左側は0.8mmの深さに注入されたマイクロニードルを使用して生理食塩水で治療しました。
GFC:本研究で使用したGFC(Cellcurin TM 、PnP Biopharm、韓国ソウル)は、インスリン様成長因子-1(IGF-1、2.5 µg/ml)、安定酸性線維芽細胞成長因子(安定aFGF、5 µg/ml)、幹細胞因子(SCF、5 µg/ml)、ケラチノサイト成長因子-2(KGF-2、5 µg/ml)、線維芽細胞成長因子9(FGF9、5 µg/ml)、ノギンペプチド(10 µg/ml)、プロテオタイド(80 µg/ml)、線維芽細胞成長因子5ショート(FGF5s、10 µg/ml)、およびニコチンアミドモノヌクレオチド(NMN、500 µg/ml)で構成されていました。
マイクロニードル:マイクロニードルデバイス( Raffine® 、Woorhi Mechatronics、韓国、安養)は、自動垂直移動( 4200~6000 rpm)を備えた9本の33ゲージマイクロニードルで構成されており、針の深さは0.1~2.0 mmに調整可能です。
治療:凍結乾燥粉末として提供された FGF5s と NMN を含む GFC は、使用前に 5 ml の生理食塩水に溶解されました。約 2.5 ml の GFC 溶液が頭皮の右側に局所的に塗布され、2.5 ml の生理食塩水が頭皮の左側に塗布されました (図 1)。両側は、0.8 mm の深さでマイクロニードル デバイスによって治療されました。各患者は、12 週間にわたって 2 週間間隔で 6 回の治療を受けました。
図1.スプリットテストのための頭皮の右側と左側への分割の模式図
パラメータ測定
治療前に各患者の頭皮の右側と左側にタトゥー ポイントを施し、毛髪の成長を比較しました。両側のタトゥーでマークされた固定領域からフォトトリコグラム (Folliscope ® 2.8、Lead M、ソウル、韓国) を撮影し、ベースラインと治療終了時の毛髪の密度と直径を測定しました。研究について知らない公平な調査員がフォトトリコグラム画像を使用して毛髪の数と毛髪の直径を数えました。
統計分析
すべてのデータは平均±標準偏差として表されます。同じ患者に対する治療の有効性をテストするために、STATA/SE ver.12 (Stata Corp LP、米国テキサス州カレッジステーション) を使用して Wilcoxon の対応ペア符号順位検定を実施しました。頭皮の右側と左側に対する治療効果の違いを分析するために、Student t 検定を実施しました。統計的有意性はp値 <0.05 に対して計算されました。
結果
患者の特徴
24人の患者のうち20人が12週間の治療コースを完了した。年齢は22~47歳(平均35.9±6.5歳)で、男性患者11人は平均年齢37.5±6.4歳、ハミルトン・ノーウッド分類による男性型脱毛症のタイプⅡ(2人)、タイプⅢ(6人)、タイプⅣ(3人)であった。女性患者9人は平均年齢33.9±5.9歳、ルートヴィヒスケールによる女性型脱毛症のタイプⅠ(6人)、タイプⅡ(3人)であった(表1)。
表1.研究対象患者のベースライン特性
|
合計 |
男性 |
女性 |
||
|
患者 |
20 |
11 |
9 |
|
|
平均年齢 |
35.9±6.5 |
37.5±6.4 |
33.9±5.9 |
|
|
パターン脱毛 |
||||
|
MPHL II |
2 |
|||
|
MPHL III |
6 |
|||
|
医学博士IV |
3 |
|||
|
FPHL I |
6 |
|||
|
FPHL II |
3 |
|||
|
MPHL: 男性型脱毛症、FPHL: 女性型脱毛症。 |
||||
治療効果と副作用
治療前と治療後に測定を行い、それぞれ毛髪の密度と太さを比較しました。フォトトリコグラム画像では、頭皮の右側の毛髪の密度と太さが増加しました (図 2)。治療後の右側と左側の毛髪密度と直径の変化を表 2 に示します。頭皮の右側では、毛髪密度が 182.5±13.1/cm 2から 188.7±13.4/cm 2 ( p値 <0.0001) に増加し、毛髪直径は 62.1±9.3 µm から 64.05±9.2 µm ( p値 <0.0112) に増加しました。左側では有意差はありませんでした。毛髪密度は181.9±16.4/cm 2から181.9±15.8/cm 2 ( p値=0.3650) に、毛髪直径は62.1±8.3 µm から62.4±8.7 µm ( p値=0.4076) に増加しました (図3)。また、わずかな痛みを除いて、治療に関連する副作用はありませんでした。
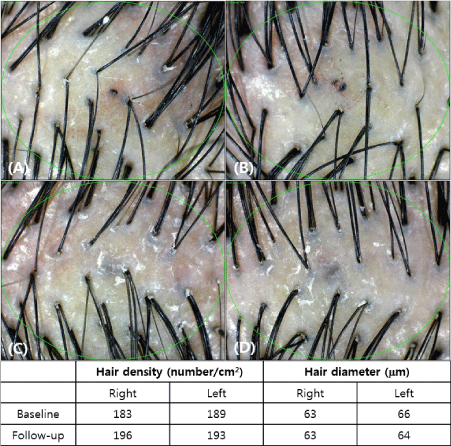
図 2. 12 週間の治療後の写真毛髪画像の評価 (A: ベースライン、頭皮の右側、B: ベースライン、頭皮の左側、C: 12 週間後、頭皮の右側、D: 12 週間後、頭皮の左側)
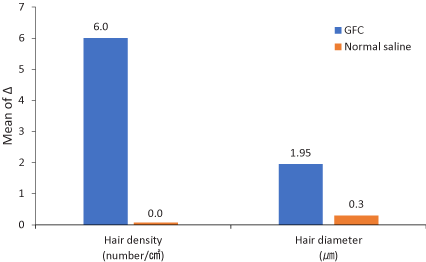
図3.ベースラインから治療後12週間までの変化。グラフは、右側のパラメータ(GFC)の増加が左側のパラメータ(生理食塩水)の増加よりも大きいことを示しています。GFC:成長因子カクテル
表2.ベースラインと治療後2週間における毛髪密度と直径の変化の統計分析
|
ベースライン 平均±SD |
12週間 平均±SD |
Δ |
p値 |
||
|
毛髪密度 |
世界金融危機 |
182.5±13.1 |
188.7±13.4 |
6.2±0.43 |
<0.0001 |
|
(個数/cm 2 ) |
生理食塩水 |
181.9±16.4 |
181.9±15.8 |
0.0±0.3 |
0.365 |
|
毛の直径 |
世界金融危機 |
62.1±9.3 |
64.05±9.2 |
1.95±0.44 |
<0.0112 |
|
(µm) |
生理食塩水 |
62.1±8.3 |
62.4±8.7 |
0.3±0.2 |
0.4076 |
|
GFC: 成長因子カクテル、SD: 標準偏差、Δ: 変化。 |
|||||
議論
男性型脱毛症は、特徴的な分布を示す頭皮の硬毛の進行性脱毛症の最も一般的なタイプです [4]。AGA はアンドロゲン依存性疾患であり、ジヒドロテストステロン (DHT) が毛包の変化に最も大きな影響を及ぼすと考えられています [5]。DHT はテストステロンの代謝物であり、テストステロンよりもアンドロゲン受容体への親和性が高い。DHT は、アンドロゲン受容体とタイプ 2 5-還元酵素が頻繁に発現する毛の真皮乳頭に作用し、毛包の小型化を誘発し、硬毛を軟毛に変換します [6]。女性型脱毛症の原因はまだ明らかではありませんが、研究により、男性型脱毛症と関連していることが示されています。男性型脱毛症も、ホルモンの不均衡が部分的に寄与しています [7]。男性では、脱毛は前頭部から始まり、頭頂部が薄くなり、最終的にハミルトン・ノーウッド分類に該当する完全な脱毛に至ります。女性型脱毛症は、前頭部の生え際は維持されたまま、中心頭頂部の脱毛として現れ、ルートヴィヒ型に分類されます。現在、脱毛症の治療に最も一般的に使用されているFDA承認薬はフィナステリドと外用ミノキシジルであり、医療機器による治療には低出力レーザー光線療法(LLLT)があり、各方法の治療効果のメタアナリシスではプラセボ群よりも有意に高い治療効果が得られました[1]。
毛包は、拡散性、細胞およびマトリックス結合因子によって媒介される可能性が高い複雑な一連の相互作用により、発達中の皮膚に発生します。毛包周期のメカニズムについては、上皮間葉相互作用、ホルモン、成長因子、その他の食事の変化などの毛包外成長調節シグナルなど、さまざまな仮説が導入されています[8]。私たちはこれまで、脱毛症を治療するために毛包に対するさまざまな毛髪成長因子の効果に焦点を当てたいくつかの研究を行ってきました。この研究では、以前の毛髪の成長に寄与する7つの成長因子(IGF-1、安定aFGF、SCF、KGF-2、FGF9、ノギンペプチド、およびプロテアチド)を、FGF5sとNMNを添加した基本溶液の形で使用しました。IGF-1は毛包の数を増やし、成長期を延長することが示されている[9]。さらに、成長期の毛包細胞の増殖を刺激し、用量依存的に毛包における形質転換成長因子β1(TGF-β1)の発現をダウンレギュレーションし、毛包が退行期に入るのを防ぎます[9]。SCFは、c-kit経路を介してメラノサイトを活性化することにより、皮膚と毛髪の色素沈着に重要な役割を果たすことが実証されています[10]。AGA患者から得られた培養真皮乳頭細胞は、真皮乳頭でのアンドロゲンによるSCF産生の阻害により、正常細胞よりもSCF分泌が少ない[10]。KGFは、紫外線照射、化学療法薬、または細胞毒性剤によって引き起こされる細胞死から表皮と毛包を保護することが報告されています[10]。 FGF は表皮細胞と間葉系細胞の機能制御に関与していると考えられており、発達中の皮膚付属器の細胞の増殖と分化にも影響を及ぼす可能性が高い [11]。発達中の毛包と成熟毛包の増殖領域に隣接する塩基性 FGF (bFGF) の免疫局在は、この因子が上皮由来細胞の有糸分裂活動を調節する可能性を示唆している。一方、酸性 FGF (aFGF) は毛包球の分化細胞に現れ、それによって毛包または繊維の構造成分の形成に関与している可能性がある [11]。FGF9 は Wnt 発現の誘発因子であり、毛包再生因子であることが報告されている [12]。ノギンは骨形成タンパク質 (BMP) の拮抗薬であり、休止期から成長期への移行を抑制します [13]。ノギンの過剰発現は成長期毛包のサイズを拡大させる [13]。FGF5s は、毛の成長を阻害する FGF5 の働きを阻害することで毛の成長を促進する成長因子である。FGF5s には、成長期を遅らせ、IGF-1 やノギンなどの毛の成長に重要な因子をアップレギュレーションする作用があることが確認されている [14-16]。NMN は NAD+ の前駆体であり、NAD+ 依存性シグナル伝達は細胞内の異化反応やエネルギー産生に重要な役割を果たしている [17]。NAD+ は、酸化的リン酸化やアデノシン三リン酸 (ATP) 産生、コレステロール、脂肪酸、ステロイドの合成など、いくつかの重要な生物学的プロセスで主要な役割を果たす必須のピリジンヌクレオチドである [18]。
Leeら[19]は、女性型脱毛症の女性に対する5週間にわたるマイクロニードリングによるGFCの短期治療の効果を報告した。我々の以前の研究は、GFC治療が効果的に毛髪の成長と太さをもたらし、その効果はマイクロニードルの深さに応じて異なることを確認した。bFGF、血管内皮成長因子(VEGF)、KGF-2、SCF、IGF-1、スーパーオキシドディスムターゼ-1(SOD-1)、およびFGF9を含むGFCを0.8mmの深さに注入した頭皮では毛髪密度が17.5%増加し、生理食塩水を使用して治療した頭皮では4%増加した[20]。Roら[21]は、IGF-1、bFGF、VEGF、SCF、KGF-2、ノギンペプチド、およびSOD-1を含む溶液を0.5mmの深さに塗布した後、毛髪の密度と太さが有意に増加したと報告した。 [22]は、マイクロニードリングの代わりにイオントフォレシスを用いてIGF-1、bFGF、VEGF、SCF、KGF-2、ノギンペプチド、SOD-1、FGF9、FGF5sを含むGFCを24週間塗布し、毛髪数が有意に増加したと報告した。先行研究[20,21]と比較して、FGF5sとNMNはGFCに添加され、この研究では毛髪密度の変化は有意ではなかった。
最近、マイクロニードリングが薬物の浸透を促進し、発毛を促進するメカニズムの 1 つであることが示唆されています。マイクロニードリングによって引き起こされる微小損傷は、最小限の表面出血につながり、さまざまな成長因子を放出する創傷治癒カスケードを引き起こします。たとえば、成長因子アルファとベータ (TGF-α と TGF-β) を変換する血小板由来成長因子 (PGF)、結合組織活性化タンパク質、結合組織成長因子、線維芽細胞成長因子 (FGF) [23] などです。繰り返しマイクロニードル刺激を与えると、発毛が誘発され、マウスモデルで Wnt3α、β-カテニン、VEGF、Wnt10b mRNA およびタンパク質の発現が増加します [23]。マイクロニードルは、薬物送達を強化するために皮膚バリアを貫通するのに十分な深さである必要がありますが、皮膚の損傷と痛みを最小限に抑えるのに十分な短さである必要があります。これまでの研究により、適切な深さは 0.5~0.8 mm であることがわかりました。そのため、この研究では最大の効果を得るために、この範囲内で最も深い深さが選択されました[20,23,24]。しかし、生理食塩水で処理した左側の頭皮では、毛髪の密度と太さに有意な差は見られませんでした。
この研究の結果は、成長期に毛包周囲の血管新生を強く誘導する VEGF を併用した GFC を使用した以前の研究の結果よりも効果が低かった。マイクロニードリングは VEGF を増加させるため、VEGF を使用した場合の育毛効果は大きかった。また、左側の頭皮への影響は最小限であったが、これは臨床医から頭皮への力の伝達が不適切または弱いことに起因する可能性がある。したがって、マイクロニードリングの力は右側の頭皮でもわずかであり、そのため右側と左側の両方で毛髪密度が大幅に増加しなかったと結論付けることができる。さらに、この研究の参加者の毛髪密度は以前の研究よりも高かったため、本研究には選択バイアスがあった可能性があることを示唆している。したがって、さらなるランダム化比較研究が必要である。本研究のその他の重要な制限は、登録された患者数が比較的少ないことと研究期間が短いことである。さらに、マイクロニードリングの手順は、臨床医のスキルに応じてエラーが発生する可能性がある。マイクロニードルによる刺激の強度レベルは、臨床医の力に応じて変化する可能性があります。最終的には、さまざまな注入深度と管理された臨床設定による研究を行って、最も効果的なマイクロニードル深度を決定する必要があります。
AGA治療に使用される薬剤は、さまざまな副作用を引き起こすことが報告されています。フィナステリドは性機能を低下させ、勃起不全、性欲減退、射精障害の原因となります[25]。また、外用ミノキシジルには、接触性皮膚炎、刺激性皮膚炎、顔面多毛症などの軽度の副作用があります[26]。
いくつかの研究でLLLTの有用性が実証されています。提案されているメカニズムには、細胞有糸分裂の促進、毛包幹細胞または毛包ケラチノサイトの刺激、アデノシン三リン酸産生および細胞活動の増加への影響、抗炎症効果などがあります[27]。私たちの意見では、GFC治療を伴うこの治療法は、AGA治療のための副作用がほとんどなく、興味深い選択肢であると思われます。
結論
この研究では、FGF5sとNMNを併用したGFCは、AGA患者の発毛と増毛に効果的な治療法であることが示されました。この治療法は副作用がほとんどないため、副作用に対する感受性や薬剤に対する禁忌のために治療が難しい患者にも使用できます。また、この治療法はフィナステリド、ミノキシジル、LLLTと併用できるという利点もあります。この研究では、AGAに加えて使用できるGFCによる治療の有効性が確認されました。ただし、治療効果をより正確に確認するには、多くの患者を対象とした追加研究が必要であり、さらなる評価によって治療の正確なメカニズムが明らかになるでしょう。
利益相反
この記事に関連する潜在的な利益相反は報告されていません。
謝辞
Cellcurin™ は PNP Biopharm (韓国ソウル) より提供されました。この研究 ( 2019-07-013 ) は、韓国の高陽 10475 にある Myongji 病院の臨床教授の研究プログラムの一環として実施されました。
参考文献
- Adil A, Godwin M (2017) 男性型脱毛症の治療の有効性: 系統的レビューとメタ分析。J Am Acad Dermatol 77: 136‐141. [Crossref]
- Avram M、Rogers N (2009) 現代の毛髪移植。皮膚外科35: 1705‐1719. [Crossref]
- Leavitt M, Perez-Meza D, Rao NA, Barusco M, Kaufman KD, et al. (2005) フィナステリド(1 mg)の毛髪移植への影響。Dermatol Surg 31: 1268‐1276. [Crossref]
- Blume-Peytavi U、Blumeyer A、Tosti A、Finner A、Marmol V、et al. (2011) 男性、女性、青年期の男性型脱毛症の診断評価のための S1 ガイドライン。Br J Dermatol 164: 5-15. [Crossref]
- 乾 誠、伊丹 誠 (2013) ヒト毛包に対するアンドロゲンの作用:展望。Exp Dermatol 22: 168-171. [Crossref]
- Imperato-McGinley J、Guerrero L、Gautier T、Peterson RE (1974) 男性におけるステロイド5α 還元酵素欠損症: 男性偽性両性具有の遺伝形式。Science 186: 1213-1215. [Crossref]
- Smith MA、Wells RS(1964)「男性型脱毛症、円形脱毛症、および女性の正常な毛髪」 Arch Dermatol 89:155-158。
- Stenn KS、Paus R (1999) 毛包サイクルを制御するものは何か? Exp Dermatol 8: 229‐236. [Crossref]
- Li J, Yang Z, Li Z, Gu L, Wang Y, et al. (2014) 外因性 IGF-1 は、C57BL/6 マウスの細胞増殖を刺激し、TGF-β1 をダウンレギュレーションすることで、体内で毛髪の成長を促進します。Growth Horm IGF Res 24: 89-94. [Crossref]
- Grichnik JM、Burch JA、Burchette J、Shea CR (1998) SCF/KIT 経路は正常なヒトメラノサイトの恒常性の制御に重要な役割を果たす。J Invest Dermatol 111: 233-238. [Crossref]
- du Cros DL (1993) 毛髪の発達における線維芽細胞成長因子と表皮成長因子。J Invest Dermatol 101: 106S-113S。 [Crossref]
- Gay D, Kwon O, Zhang Z, Spata M, Plikus MV, et al. (2013) 真皮γδT細胞由来のFgf9は創傷後の毛包新生を誘導する。Nat Med 19: 916-923. [Crossref]
- Botchkarev VA、Botchkareva NV、Sharov AA、Funa K、Huber O、et al. (2002) ノギンによる BMP シグナル伝達の調節は二次(非チロトリク)毛包の誘導に必要である。J Invest Dermatol 118: 3-10. [Crossref]
- Li WR, He SG , Liu CX, Zhang XM, Wang LQ, et al. (2017) FGF5sの異所性発現は中国のメリノ羊の羊毛の成長を誘導する。Gene 627: 477‐483. [Crossref]
- He X、Chao Y、Zhou G 、Chen Y (2016) 線維芽細胞増殖因子5短鎖(FGF5s)はカシミヤヤギの一次および二次毛包真皮乳頭細胞におけるFGF5の活性を阻害する。Gene 575: 393‐398. [Crossref]
- 伊藤 千恵子、斉藤 勇、藤田 勇、山崎 勇、今村 剛、他 (2003) 線維芽細胞増殖因子 (FGF)-5 部分配列を有するデカペプチドは FGF-5 の毛髪成長抑制活性を阻害する。J Cell Physiol 197: 272‐283. [Crossref]
- Pehar M, Harlan BA, Killoy KM, Vargas MR (2018) ニコチンアミドアデニンジヌクレオチド代謝と神経変性。抗酸化レドックスシグナル28: 1652‐1668. [Crossref]
- Braidy N、Berg J、Clement J、Khorshidi F、Poljak A、et al. (2019) ニコチンアミドアデニンジヌクレオチドおよび関連前駆体の加齢性変性疾患の治療標的としての役割:理論的根拠、生化学、薬物動態、および結果。Antioxid Redox Signal 30: 251-294. [Crossref]
- Lee YB、Eun YS、Lee JH、Cheon MS、Park YG、他 (2013) 女性型脱毛症の女性に対する成長因子の局所塗布とマイクロニードル療法の効果:パイロットスタディ。J Dermatol 40: 81-83. [Crossref]
- Ro BI、Lee SY、Kim JB、Shin HC (2017) パターン脱毛症患者における線維芽細胞増殖因子9を含む増殖因子カクテルの治療効果。Korean J Dermatol 55: 504-511。
- Ro BI、Son HO、Chun SW、Shin HC(2016)「マイクロニードルの深さに応じた男性型脱毛症患者に対する成長因子カクテル治療の治療効果」 Korean J Dermatol 54:184-190。
- Ro BI、Kim SM、Kang JW、Shin HC(2020)「男性型脱毛症患者における線維芽細胞増殖因子5ショートを含む成長因子カクテルの頭皮へのイオントフォレシスの効果 - 分割研究」 Glob Dermatol 7:2-4。
- Kim YS、Jeong KH、Kim JE、Woo YJ、Kim BJ、他 (2016) マイクロニードルの反復刺激はマウスモデルにおいて毛髪の成長を促進する。Ann Dermatol 28: 586-592. [Crossref]
- Ro BI、Chun SW、Lee SY、Shin HC (2016) 男性型脱毛症患者における線維芽細胞増殖因子9を含む増殖因子カクテルの治療効果 - 分割研究。Glob Dermatol 3: 404-408。
- Mella JM、Perret MC、Manzotti M、Catalano HN、Guyatt G (2010) 男性型脱毛症に対するフィナステリド療法の有効性と安全性:系統的レビュー。Arch Dermatol 146: 1141-1150. [Crossref]
- Ebner H, Müller E (1995) ミノキシジルによるアレルギー性接触皮膚炎。接触皮膚炎32: 316-317。
- Jimenez JJ、Wikramanayake TC、Bergfeld W、Hordinsky M、Hickman JG、他 (2014) 男性型および女性型脱毛症の治療における低出力レーザー機器の有効性と安全性: 多施設ランダム化偽機器対照二重盲検試験。Am J Clin Dermatol 15: 115-127. [Crossref]




